Atommasse vs. atomnummer
Innhold
- Innhold: Forskjell mellom atommasse og atomnummer
- Hva er atommasse?
- Hva er atomnummer?
- Viktige forskjeller
Atommasse og atomnummer er de to begrepene som er mye brukt i begrepene kjemi og fysikk. For å forstå de viktigste vitenskapsbegrepene har begge disse begrepene den betydningen. De fleste gangene disse to begrepene er forvirrende for folket, bytter de begge disse vilkårene. Imidlertid er de nettopp veldig unike fra hverandre, selv om begge disse begrepene har noen likheter, men de er forskjellige fra hverandre. Egenskaper og egenskaper ved forskjellige materialer, stoffer og elementer kan ikke forstås ved å forstå betydningen av disse begrepene. Atomnummer brukes for å tydelig definere hvilken type element et materiale eller stoff er. Det er definert og beskrevet som antall protoner som er inneholdt i et elementets kjerner, mens, på den annen side, Atommassen absolutt er antallet som er assosiert med både protonene og også nøytroner i den bestemte kjernen assosiert med elementet. Elektroner veier egentlig ikke nevneverdig, derfor bestemmes atommassen faktisk med tilsetningen av mengden assosiert med protoner til nøytroner. I tillegg er det kjent som atomvekten.

Innhold: Forskjell mellom atommasse og atomnummer
- Hva er atommasse?
- Hva er atomnummer?
- Viktige forskjeller
- Videoforklaring
Hva er atommasse?
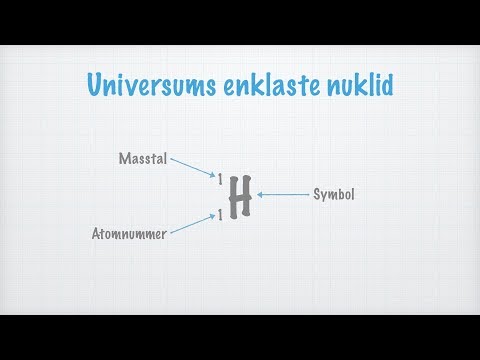
Massetallet eller kjent som atommassetall er betegnet med (A) vanligvis skrevet på oversiden av elementet, det er også referert til som atommassetall eller kanskje nukleonnummer, er definitivt den endelige mengden som involverer protoner og nøytroner (som kollektivt referert til som nukleoner) i en atomkjerne. Det bestemmer den spesielle atommassen til atomer. På grunn av det faktum protoner og nøytroner begge er baryoner, er den spesielle masse nummer A lik sammen med baryon nummer B siden den spesielle kjernen i hele atomet eller til og med ion. Massetallet er helt forskjellig for hver distinkte isotop av den kjemiske substanskomponenten. Dette er rett og slett ikke det samme som atomnummeret (Z) Massetallet presenteres noen ganger etter elementnavnet eller kanskje som et pålegg til venstre for elementets symbol. For eksempel er den mest typiske isotopen som involverer karbon definitivt karbon-12 eller 12C, som inkluderer 6 protoner i tillegg til 6 nøytroner. Det fullstendige isotopmerket vil absolutt også ha atomnummeret. Massetallet skal ikke forveksles med et annet lignende begrep som den relative atommassen til et element.
Hva er atomnummer?
Atomnummer er betegnet med "Z". Når det gjelder kjemi og fysikk, er det atomenummeret som er assosiert med et kjemisk element (også referert til som protonnummeret), definitivt antallet protoner perfekt plassert i kjernen assosiert med et atom av det elementet, og av den grunn ligner ladningsnummeret til den spesielle kjernen. Det er virkelig tradisjonelt symbolisert ved hjelp av bildet Z. Atomnummeret bestemmer utelukkende et kjemisk element. I et uladet atom er det bestemte atomnummeret også sammenlignbart med antall elektroner. Atomtallet, Z, må stoppe feil identifisert som massetallet, A, som er antallet nukleoner, Mengden nøytroner, N, gjenkjennes som nøytronnummeret assosiert med atomet; derfor A = Z + N (alle disse beløpene vil alltid være hele tall). Fordi protoner og også nøytroner har omtrent den samme massen (så vel som massen til elektronene er definitivt ubetydelig for mange formål), og masseproblemet som involverer nukleonbinding er vanligvis mindre sammenlignet med den bestemte nukleonmassen, den atome massen til Atomet, når det er angitt i enkle atomenmassenheter Atomer med nøyaktig samme atomnummer Z, men distinkte nøytrontall N, og derfor distinkte atommasser, klassifiseres som isotoper.
Viktige forskjeller
- Atomnummer er representert med “Z” mens atommasse er representert med “A”.
- Atommasse definerer ikke elementtypen, mens atomnummer definerer type element.
- Atommasse brukes for å vise forskjellige isotoper av samme element, mens det ikke er tilfelle for atomnummer.
- Atommasse måles i atommasseenheten (amu) mens atomnummeret bare er et tall.
- Et antall elektroner er alltid lik atomantallet, men ikke lik massetallet.
- Hvis atomnummeret er høyt, indikerer det at atommassen også vil være høy.